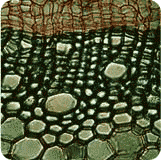
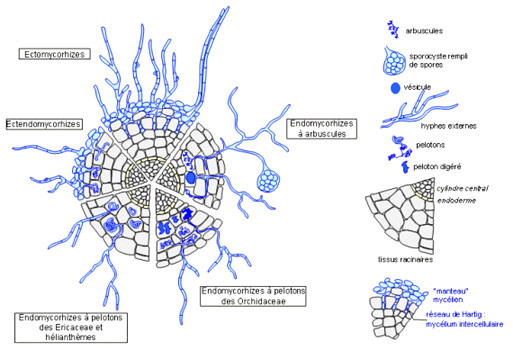
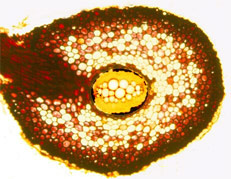
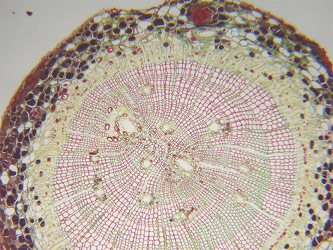
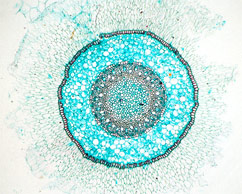
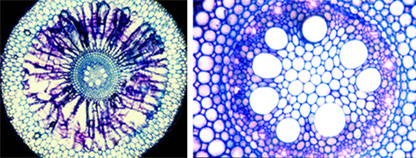
On retrouve de 2 à 6 pôles xylémien. La stèle y est toujours à symétrie radiale. Les racines jeunes, et celles ne présentant que peu de structures secondaires, ont des structures primaires parfaitement observables. Il s'agit, de l'extérieur vers l'intérieur de la coupe, des :
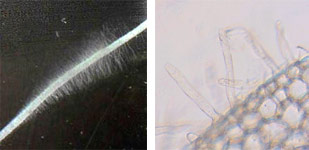
- - rhizoderme unistratifié à poils absorbants
- - exoderme unistratifié
- - parenchyme cortical très épais
- - endoderme à cadres de Caspary
- - pericycle
- - les pôles xylémiens primaires à différenciation centripète (metaxylème vers l'intérieur et protoxylème vers l'extérieur) et les pôles phloemiens primaires
On n'observe par contre pas de moelle centrale : cette disparition du parenchyme médullaire est due à la différenciation centripète des pôles xylémiens. Par contre, on ne peut pas différencier le sens de différenciation des faisceaux phloemiens, c'est à dire la localisation du protophloéme et du metaphloéme.
Le rhizoderme est une assise de cellules de protection et de revêtement, continue au niveau de l'assise pilifère et discontinue au niveau de la zone subéreuse, laissant apparaître l'assise subéreuse.
L'écorce est large, et le parenchyme cortical très développé est formé de grosses cellules à parois fines. Le parenchyme cortical comporte des lacunes aérifères dans le cas espèces vivant en milieu très humide.
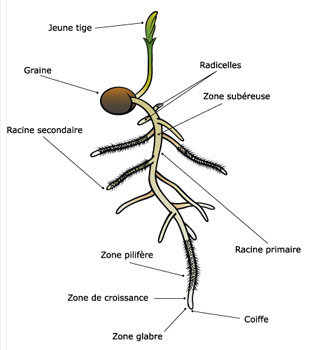
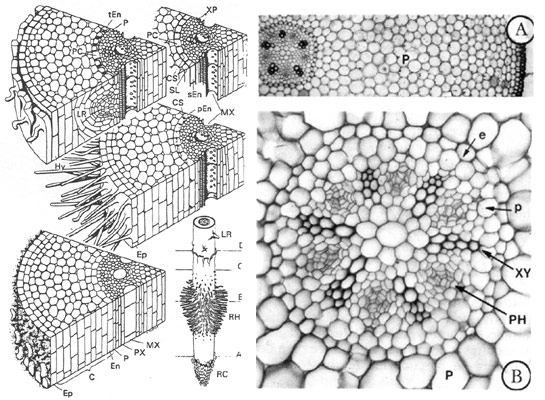 Fig. 17 et 18 : schéma tridimensionnel d'une racine primaire (en bas, à droite) et coupes transversales à quatre niveaux de la racine (A-D). A zone de croissance et de différenciation, B zone pilifère avec endoderme primaire, C zone de l'endoderme secondaire, D zone de ramification ou de formation des racines latérales, de l'hypoderme et de l'endoderme tertiaire (C écorce, CS barrière de Caspary, En endoderme, Ep épiderme, Hy hypoderme, LR ébauche d'une racine latérale, Mx métaxylème, P péricycle, PC, cellule traversée, PX protoxylème, RC coiffe, RH, poil absorbant, SL lamelle subérinique, XP parenchyme du xylème) et structure primaire de la racine de Ranunculus vicaria : A fragment de coupe transversale, B détail du cylindre central (e endoderme, p péricycle, P parenchyme cortical, XY xylème, PH phloème)
Fig. 17 et 18 : schéma tridimensionnel d'une racine primaire (en bas, à droite) et coupes transversales à quatre niveaux de la racine (A-D). A zone de croissance et de différenciation, B zone pilifère avec endoderme primaire, C zone de l'endoderme secondaire, D zone de ramification ou de formation des racines latérales, de l'hypoderme et de l'endoderme tertiaire (C écorce, CS barrière de Caspary, En endoderme, Ep épiderme, Hy hypoderme, LR ébauche d'une racine latérale, Mx métaxylème, P péricycle, PC, cellule traversée, PX protoxylème, RC coiffe, RH, poil absorbant, SL lamelle subérinique, XP parenchyme du xylème) et structure primaire de la racine de Ranunculus vicaria : A fragment de coupe transversale, B détail du cylindre central (e endoderme, p péricycle, P parenchyme cortical, XY xylème, PH phloème)
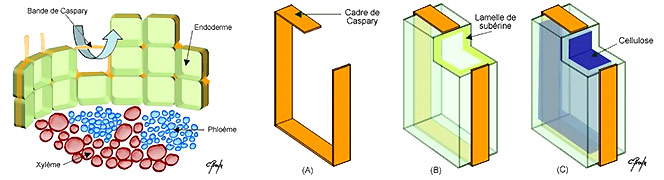
La racine contraste avec un cylindre central réduit et limité par l'
endoderme à
cadres de Caspary. Cet endoderme est épaissi chez les groupes ne présentant pas ou peu de structures secondaires. Il peut même se dédoubler, car le pericycle sous jacent fonctionne comme un vrai meristéme : il possède des pouvoirs de dédifférenciation et de division.
Ce pericycle est à l'origine de la mise en place de racines secondaires et des tissus qu'elles contiennent. Il peut comporter des éléments fibreux. Dans les familles ne possédant pas de structures secondaires, les choses en restent là. Mais, chez la plupart des familles, les restes de procambium, qui fut à l'origine des tissus conducteurs primaires, qui se situent dans la partie interne des faisceaux de phloéme primaire installent des arcs de cambium à la partie creuse formée par le phloéme primaire.
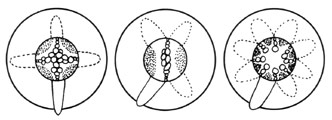
Il se forme autant d'arc cambiaux qu'il existe de massifs phloémiens. Ceux ci se racolent à d'autres arcs cambiaux, formés par dédifférenciation des cellules du pericycle à la pointe des massifs de protoxylème primaire. Il se mets alors en place, par ce raccordement, un cambium de plus en plus continu, qui au début est très sinueux (plage cambiale). Celui ci fabrique sur sa face intérieur du xylème secondaire et sur sa face extérieur du phloème secondaire. Il se développe alors le double cercle xylemien-phloemien, qui grandit de plus en plus, comme dans la tige. Le cambium reste assez longtemps de nature irrégulière. Le xylème secondaire développe en plus des rayons nombreux emprisonnant progressivement l'actinostèle des structures primaires. Ce xylème secondaire est dit hétérogène : il est constitué de bois et de vaisseaux conducteurs.
Le développement des tissus secondaires entraîne le déplacement du phloéme primaire qui vient se localiser de plus en plus à extérieur des structures primaires, mais reste encore en alternance avec les faisceaux de xylème I. Les faisceaux de phloéme primaire peuvent se lignifier. L'augmentation du diamètre entraîne l'éclatement de l'endoderme, qui est en partie hydrolysé et n'est plus visible dans un état avancé de développement des structures secondaires. Les tissus secondaires ont tendance à masquer et à éliminer les tissus primaires lorsque la racine vieillit. Enfin, à la périphérie, le rhizoderme et l'exoderme disparaissent peu à peu, et sont remplacés par du phellogène et du phelloderme subérifié (suberphelloderme), assurant la protection finale de cet organe.
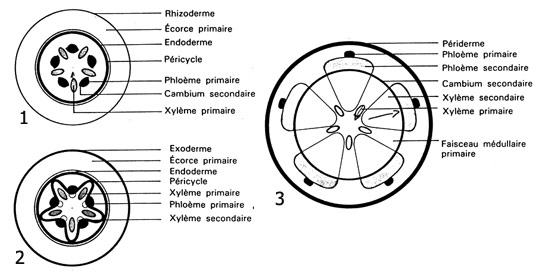 Fig. 19 : évolution de la croissance des structures secondaires dans une racine
Fig. 19 : évolution de la croissance des structures secondaires dans une racine
Les structures racinaires secondaires observables sont donc, de extérieur vers intérieur, des :
- - restes de rhizoderme et de poils absorbants, si l'âge de l'organe n'est pas trop avancé
- - suberphelloderme sur une ou deux couches
- - parenchyme cortical amincie
- - restes d'endoderme, si la racine n'est pas trop âgée
- - faisceaux de phloeme I pouvant être lignifiés
- - phloeme secondaire
- - cambium mince
- - xylème secondaire hétérogène (rayons ligneux et vaisseaux conducteurs) très épais
- - xylème primaire