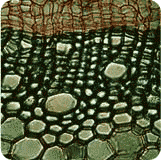
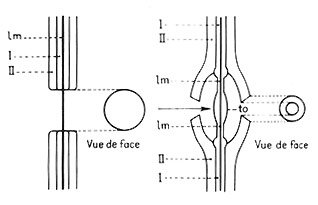
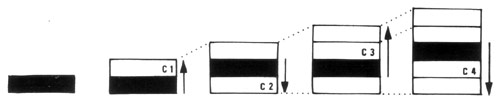
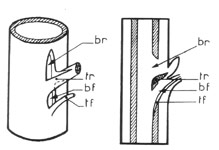
Etude macroscopiqueUne coupe transversale de branche d'arbre montre, à l'oeil nu, dans le bois, une série de couronnes concentriques, ou
cernes annuelles, chacune comprenant deux parties, l'une du côté interne, claire et relativement tendre (bois initial, ou bois de printemps aux éléments conducteurs nombreux et de fort diamètre), l'autre du cote externe, plus sombre, mince et résistance (bois final ou bois d'automne, aux éléments conducteurs rares et de petit diamètre). Le nombre de cernes indique l'âge des organes.
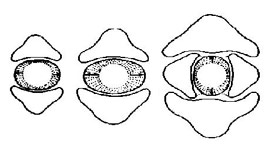
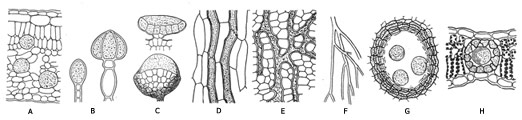
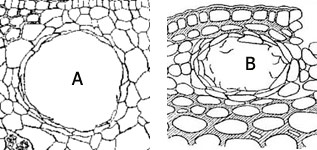
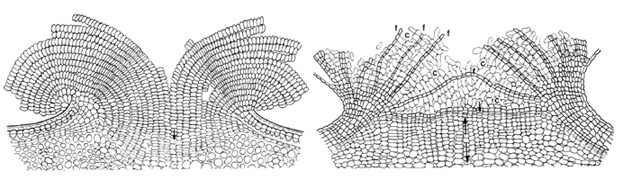
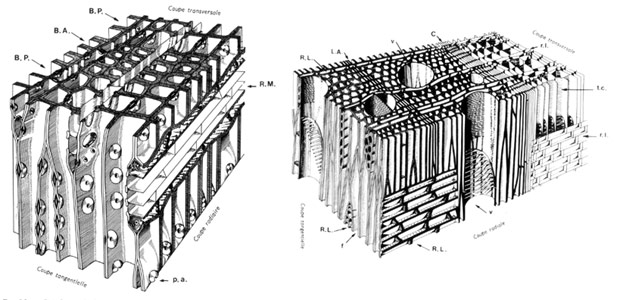 Fig. 42 : types de bois : à gauche, bois homoxylé de Pinus sylvestris, à droite, bois heteroxylé de Betula alba (BP bois de printemps, BA bois d'automne, pa ponctuation aréolée, c cambium, A limite actuelle, v vaisseau, tc tube criblé, RL rayon ligneux, rl rayon libérien, f fibre)
Fig. 42 : types de bois : à gauche, bois homoxylé de Pinus sylvestris, à droite, bois heteroxylé de Betula alba (BP bois de printemps, BA bois d'automne, pa ponctuation aréolée, c cambium, A limite actuelle, v vaisseau, tc tube criblé, RL rayon ligneux, rl rayon libérien, f fibre)
L'épaisseur des cernes annuels d'un tronc est variable :
- - d'une espèce à l'autre
- - avec l'âge de l'individu
- - avec la pluviosité (la production de bois est grossièrement proportionnelle à la pluviométrie)
- - avec l'orientation (cernes plus épais vers l'est, les plus fins vers le nord)
- - avec la pente (inégalité de nutrition)
La disposition des cernes d'un rameau plagiotrope est, le plus souvent, excentrique, les patries les plus épaisses des cernes constituant le bois de réaction. Celui ci est situé vers la face inférieure du rameau (Gymnospermes) ou vers la face supérieure (Magnolopsides). Chez différentes espèces, le bois périphérique de formation récente et relativement tendre (aubier) se distingue nettement du bois de coeur, ou duramen, plus ancien et dur. Celui ci est rendu relativement imputrescible à la suite d'un enrichissement en tanins, résines et sels d'acides organiques. Les arbres dits à bois blanc, comme les
Populus, les
Betula, les
Acer et les
Tilia ne forment pas de coeur.
Les rayons ligneux, ou parenchyme horizontal, visibles souvent à l'oeil nu, se distinguent par leur disposition radiale, leur minceur et leur couleur claire. Ils ont une longueur, une hauteur, et une épaisseur limitées, mais caractéristiques pour chaque espèce. Ils croisent les éléments verticaux du parenchyme vertical (fibres et éléments conducteurs).
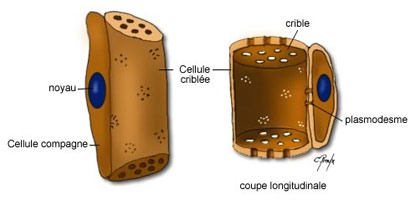
D'une manière générale, seul le bois jeune assure la conduction de la sève brute.
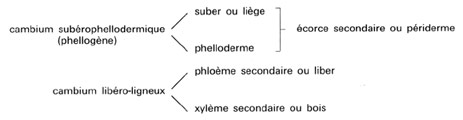
"L'arbre est encombré de tissus mortifiés ; il consiste en une pellicule de tissus indifférenciés ou peu différenciés durablement vivants et actifs, étroitement coordonnés produisant des tissus spécialisés qui fonctionnent brièvement et meurent ; le rhytidome, les feuilles usées, les racines et les branches accidentellement mortes, sont rejetés à l'extérieur ; à l'intérieur s'accumulent des strates de bois mort" (Mangenot).
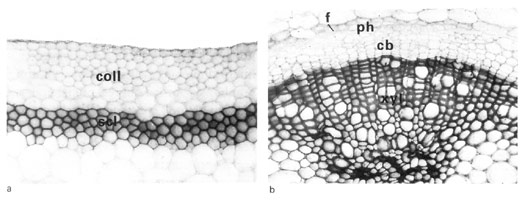
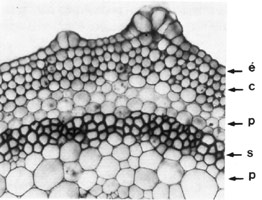
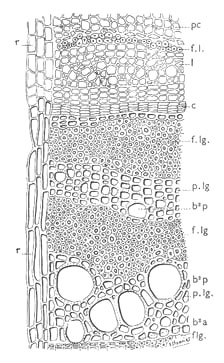 Fig. 43 : portion d'une coupe transversale de tige de Cytisus laburnum :pc parenchyme cortical, fl fibres libériennes,l liber, c cambium, f lg fibres ligneuses, p lg parenchyme ligneux cortical, r rayon ou parenchyme ligneux horizontal, b²p bois secondaire printanier, b²a bois secondaire automnal
Fig. 43 : portion d'une coupe transversale de tige de Cytisus laburnum :pc parenchyme cortical, fl fibres libériennes,l liber, c cambium, f lg fibres ligneuses, p lg parenchyme ligneux cortical, r rayon ou parenchyme ligneux horizontal, b²p bois secondaire printanier, b²a bois secondaire automnal
Etude microscopiqueLe bois est dit
homoxylé quand ses éléments conducteurs sont uniquement des trachéides et qu'il ne comporte pas de fibres (Prephanérogames, Gymnospermes, quelques Magnolopsides primitives comme les Magnoliales ). Au contraire, les éléments conducteurs d'un bois
heteroxylé sont avant tout des vaisseaux auxquels peuvent s'ajouter des trachéides (Chlamydospermes et majorité des Magnolopsides).
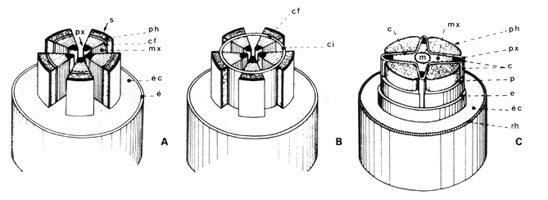
"L'existence d'un cambium producteur de bois est requise pour définir un arbre. Les propriétés du bois, matériau de grande importance économique, dépendent en fait de la structure et du mode de fonctionnement du cambium qui l'a produit. On peut même dire que c'est l'évolution du cambium qui a permis celle du bois, depuis les Ptéridophytes arborescents jusqu'aux Angiospermes actuelles." (Catesson et Lachaud). C'est ainsi que le bois des feuillus est d'autant plus évolué que les initiales fusiformes sont relativement de petite taille.